Informazioni per l’utilizzatore Indusil
RIASSUNTO DELLE CARATTERIST CHE DEL PRODOTTO
DENOMINAZIONE DEL MEDICINALE
1.
INDUSIL 30 mg polvere e solvente per soluzione orale.
2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
Il flacone polvere contiene:
Principio attivo
Cobamamide 30 mg
(dopo la solubilizzazione 10 gocce contengono 1 mg di Cobamamide).
Per l’elenco completo degli eccipienti, vedere paragrafo 6.1.
3. FORMA FARMACEUTICA
Polvere e solvente per soluzione orale.
4. INFORMAZIONI CLINICHE
4.1 Indicazioni terapeutiche
In tutti i casi di carenza di Vitamina B12 per aumentata richiesta e ridotto apporto dietetico.
4.2 Posologia e modo di somministrazione
Adulti: 10-20 gocce 2-3 volte al giorno (10 gocce = 1 mg).
Bambini: 10 gocce 2-3 volte al giorno.
NON SUPERARE LE DOSI CONSIGL IATE.
Le gocce possono eventualmente essere agg>ui*e d acqua o latte ed altro liquido, senza che ne venga modificato il sapore.
4.3 Controindicazioni
Ipersensibilita al principio attivo o ad uno qualsiasi degli eccipienti.
4.4 Avvertenze tpe^ iali ° p:^ auzioni di impiego
I prodotti contenen+i cobam .mide non dovrebbero essere somministrati a soggetti anemici se non sulla base di indagini volte a stabilire l’esatta natura dell’anemia. Una somministrazione non mirata del prodotto puo condurre ,d tk i diagnostici.
II tr .‘amt nto d'gli sLati anemici va condotto sotto controllo ematologico.
Data la particolare labilita e fotosensibilita della cobamamide l’eventuale soluzione del prodotto in liquidi o la sua .iiiscelazi'ae in altri alimenti deve avvenire immediatamente prima del momento della somministrazione.
Dopo breve periodo di trattamento senza risultati apprezzabili, consultare il medico.
4.5 Interazioni con altri medicinali e altre forme di interazione
Non sono stati effettuati studi di interazione. Non sono note interazioni con altri farmaci.
4.6 Gravidanza e allattamento
Gli studi sugli animali non mostrano una tossicita riproduttiva (vedere paragrafo 5.3).
L’uso di Indusil durante la gravidanza puo essere considerato, purché vengano rispettate le normali dosi terapeutiche e sussista realmente l’indicazione medica al trattamento.
4.7 Effetti sulla capacitá di guidare e di usare macchinari
Non sono stati effettuati studi sulla capacitá di guidare veicoli e sull’uso di macchinari.
4.8 Effetti indesiderati
L’impiego di cobamamide, puo raramente essere seguito da reazioni generali d’ipersensibilitá (febbre, ipotensione, eruzioni cutanee, anafilassi).
4.9 Sovradosaggio
Non sono stati riportati casi di sovradosaggio.
5. PROPRIETA' FARMACOLOGICHE
Categoria farmacoterapeutica: Vitamina B12 - Antianemico.
Codice ATC: B03BA04.
5.1 Proprietá farmacodinamiche
La cobamamide e la forma coenzimatica della vitamina B12 dotata di forte potere anabolizzante: nell’animale favorisce la ritenzione azotata, contrasta ’’effetto c^tab olizzante e gastrolesivo del prednisolone, influenza positivamente la matrice proteica dell’osso. Favorisce la captazione di aminoacidi delle cellule epatiche e dei reticolociti in misura piu evident dJla cia.ocobalamina e dell’idrossicobalamina. Svolge azione antianemica ed epatoprotettiva in a' ^ne c.ond;zioni sperimentali (anemia da fenilidrazina e da piombo, epatite da CCl4).
5.2 Proprietá farmacocinetiche
La cobamamide viene assorbita gradualmente dall’intestino, si lega alle proteine plasmatiche e si accumula preferibilmente nel fegato e in min or misura nel rene. Il rapporto di incorporazione rene/fegato per la cobamamide e inferiore a quello dell’idrossi e della cianocobalamina; viene escreta prevalentemente per via renale piu lentamente e in misura inferiore della ciano e dell’idrossicobalamina.
5.3 Dati preclinici di sicurezza
Ha una scarsr sim a to^sicitá. La DL50 (os, e.v., i.p.) e superiore a 2.000 mg/kg. Anche le prove di tossicitá cronica dicumei+anr una buona tollerabilitá della cobamamide fino a dosi di 50-100 mg/kg/die. Nelle prove di ttra^ogenesi, ’osi di 10-50 mg/kg non hanno influito sulla gravidanza e sullo sviluppo dei neonati.
Prove in vitro e in vivo hanno escluso l’eventualitá di rischi anafilattogeni.
6. INFORMAZIONI FARMACEUTICHE
6.1 Elenco degli eccipienti
Il flacone polvere contiene:
Mannite.
Il contenitore monodose di solvente contiene:
Benzalconio cloruro, acqua depurata.
6.2 Incompatibilitá
Nessuna.
6.3 Periodo di validitá
5 anni.
6.4 Precauzioni particolari per la conservazione
La soluzione ricostituita deve essere conservata a temperatura inferiore a 25°C nella confezione originále per proteggere il medicinale dalla luce.
Il periodo di validita della soluzione ricostituita e di 30 giorni.
6.5 Natura e contenuto del contenitore
La polvere e contenuta in flaconcini di vetro giallo tipo III ricoperto con plastica ne~a opa^a pro'.isti di tappi in gomma butilica e ghiera metallica.
Il solvente e contenuto in contenitori monodose in accoppiato polietilt.e/PVC/PvDC sigillati per termosaldatura.
Astuccio contenente 1 flacone di polvere + 1 contenitore monodose di solvente.
6.6 Precauzioni particolari per lo smaltimento e la manipolazione
Nessuna istruzione particolare.
7. TITOLARE DELL’AUTORIZZAZIONE AlL” MMISSiONE IN COMMERCIO
RECORDATI Industria Chimica e Farmaceutica S.p.A. - Via Civitali, 1 - MILANO su licenza DIAMANT - Francia
8. NUMERO DELL’AUTOR ZZA ziONE ALL’IMMISSIONE IN COMMERCIO
“30 mg polvere e solvente per soluzione orale” 1 flacone di polvere + 1 contenitore monodose solvente da 15 ml A.I.C. n. 021196112
9. DATA DEL l A PR IMa AUTORIZZAZIONE/RINNOVO DELL’AUTORIZZAZIONE
Data di prima aut’riz.azione: 27.11.1969 Rinnovo dell’autorizzazione: 31.05.2010
10. D aÍA DI P eVISIONE DEL TESTO
Maggio 2013
Documento reso disponibile da AIFA il 12/11/2013 4
Riassunto delle caratteristiche del prodotto Indusil
FOGLIO ILLUSTRATIVO
PRIMA DELL’USO
LEGGETE CON ATTENZIONE TUTTE LE INFORMAZIONI CONTENUTE NEL FOGLIO
ILLUSTRATIVO
Questo e un medicinale di AUTOMEDICAZIONE che potete usare per curare disturbi lievi e transitori facilmente riconoscibili e risolvibili senza ricorrere all’aiuto del medico.
Puo essere quindi acquistato senza ricetta ma va usato correttamente per assicurarne l’efficacia e ridurne gli effetti indesiderati.
• per maggiori informazioni e consigli rivolgetevi al farmacista
• consultate il medico se il disturbo non si risolve dopo un breve periodo di trattamento.
INDUSIL
30 mg polvere e solvente per soluzione orale
(Cobamamide)
CHE COSA E
INDUSIL e un prodotto contenente cobamamide, forma coenzimatica della vitamina B12 dotata di forte potere anabolizzante ed indicata negli stati di carenza di vitamina B12.
PERCHE SI USA
INDUSIL si usa in tutti i casi di carenza di Vitamina B12 per aumentata richiesta e ridotto apporto dietetico.
QUANDO NON DEVE ESSERE USATO
Ipersensibilita al principio attivo o altre socana1 strata .ente correlate dal punto di vista chimico; in particolare verso cianocobalamina, idroxocobalamina, etiocobalamina o ad uno qualsiasi degli eccipienti.
PRECAUZIONI PER L’USO
I prodotti contenenti cobamamide non dovrebbero essere somministrati a soggetti anemici se non sulla base di indagini volte a stabilire l’esatta natura dell’anemia. Una somministrazione non mirata del prodotto puo condurre ad errori diagnostici.
II trattamento degli stati anemici va condotto sotto controllo medico.
La soluzione ottenuť umndo la polvere di cobamamide al solvente, una volta preparata, deve essere consumata entro 30 gior. i.
Inoltre, data la p-tico'an la’'ilita e fotosensibilita della cobamamide, l’eventuale soluzione del prodotto in liquidi o la ua m.'scelazi<_ne in altri alimenti deve avvenire immediatamente prima del momento della somministrazione.
QUAI MEdI CINALI O ALIMENTI POSSONO MODIFICARE L’EFFETTO DEL MEDICINALE
Informare il medico o il farmacista se si e recentemente assunto qualsiasi altro medicinale, anche quelli senza prescrizione medica.
E IMPORTANTE SAPERE CHE
Quando puo essere usato solo dopo aver consultato il medico
Nei soggetti anemici INDUSIL deve essere usato solo dopo aver consultato il medico e aver valutato con lui il rapporto rischio /beneficio nel proprio caso.
E opportuno consultare il medico anche nei casi in cui tali disturbi si fossero manifestati in passato.
Cosa fare durante la gravidanza e l’allattamento
Chiedere consiglio al medico o al farmacista prima di prendere qualsiasi medicinale.
Gli studi sugli animali non hanno mostrato tossicita riproduttiva.
L’uso di INDUSIL durante la gravidanza puo essere considerato, purché vengano rispettate le normali dosi terapeutiche e sussista realmente l’indicazione medica al trattamento.
Effetti sulla capacitá di guidare e di usare macchinari
Non sono stati effettuati studi sulla capacita di guidare veicoli e sull’uso di macchinari.
Informazioni importanti su alcuni eccipienti: niente da segnalare.
COME USARE QUESTO MEDICINALE Quanto
Adulti: 10-20 gocce 2-3 volte al giorno (vedere Come).
Bambini: 10 gocce 2-3 volte al giorno (vedere Come).
Attenzione: non superare le dosi indicate senza il consiglio del medico.
Quando e per quanto tempo
Attenzione: usare solo per brevi periodi di trattamento.
Consultate il medico se il disturbo si presenta ripetutamente o se avete r^atc un qualsiasi cambiamento recente delle sue caratteristiche.
Come
Le gocce possono eventualmente essere aggiunte ad acqua o la++Q ed altro liquido, immediatamente prima della somministrazione e senza che ne venga modificato il s^po. e.
ISTRUZIONI PER L’USO DI INDUSil GOCCE
Aprire il contenitore strappandone la linguetta.
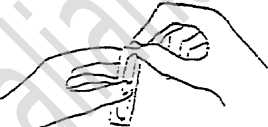
Aprire il flacone contenente la polvere e versarvi il solvente premendo il contenitore.

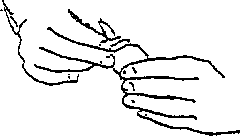
Inserire a pressione il contagocce sul flacone. Agitare leggermente per ottenere la soluzione.
Al momento dell’uso: togliere il cappuccio del contagocce e premere per ottenere la caduta
delle gocce.
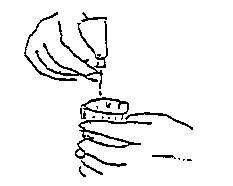
COSA FARE SE AVETE PRESO UNA DOSE ECCESSIVA DI MEDICINALE
In caso di ingestione/assunzione accidentale di una dose eccessiva di INDUSIL avvertite imm dia^mente il medico o rivolgetevi al piu vicino ospedale.
Se si ha qualsiasi dubbio sull’uso di INDUSIL, rivolgersi al medico o al farmacista.
EFFETTI INDESIDERATI
Come tutti i medicinali, INDUSIL puo causare effetti indesiderati sebbene non tutte le persone li manifestino.
L’impiego di cobamamide puo raramente essere seguito da reazioni generali ďipersensibilitá (febbre, ipotensione, eruzioni cutanee, anafilassi).
Questi effetti indesiderati sono generalmente transitori. Qua ndo si presentano e tuttavia opportuno consultare il medico o il farmacista.
Il rispetto delle istruzioni contenute nel foglio illustra .ivo riduce ;1 rischio di effetti indesiderati.
Se uno qualsiasi degli effetti indesiderati si aggrava, o se nota la comparsa di un qualsiasi effetto indesiderato non elencato in questo foglio illustrativo, informi il medico o il farmacista.
SCADENZA E CONSERVAZIONE
Scadenza: Vedere la data di scadenza riportaa sulla confezione.
La data di scadenza si riferisce al prodotto in confezionamento integro, correttamente conservato. Attenzione: non utilizzare il medicinale d^p la data di scadenza riportata sulla confezione.
La soluzione ricostituita d.ve essere conservata a temperatura inferiore a 25°C nella confezione originale per proteggere il medicinale dalla luce.
Il periodo di validitá della soluzione ricostituita e di 30 giorni.
I medicinali non devono essere gettati nell’acqua di scarico e nei rifiuti domestici. Chieda al farmacista come elimina. e i medicinali che non utilizza piu. Questo aiuterá a proteggere l’ambiente.
TENERF Il MF DICiNALE FUORI DALLA VISTA E DALLA PORTATA DEI BAMBINI.
COMPOSIZIONE
Ogni flacone di polvere contiene:
Principio attivo
Cobamamide 30 mg
(dopo la solubilizzazione 10 gocce contengono 1 mg di Cobamamide).
Eccipienti
Mannite.
Il contenitore monodose di solvente contiene:
Benzalconio cloruro, acqua depurata.
COME SI PRESENTA
INDUSIL si presenta sottoforma di polvere e solvente per soluzione orale. In particolare il contenitore contiene un flacone da 30 mg di Cobamamide in polvere + un contenitore monodose di solvente da 15 ml.
TITOLARE DELL’AUTORIZZAZIONE ALL’IMMISSIONE IN COMMERCIO
RECORDATI Industria Chimica e Farmaceutica S.p.A. - Via Civitali, 1 - Milano.
PRODUTTORE
RECORDATI S.p.A. - Officina di Milano - Via Civitali, 1.
Revisione del Foglio Illustrativo da parte dell’Agenzia Italiana del Farmaco: Maggio 20^3
Documento reso disponibile da AIFA il 12/11/2013 5