Informazioni per l’utilizzatore Plenadren
ALLEGATO I
RIASSUNTO DELLE CARATTERIS ticHe de l PRODOTTO

1. DENOMINAZIONE DEL MEDICINALE
Plenadren 5 mg compresse a rilascio modificato
2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
Ogni compressa a rilascio modificato contiene: idrocortisone 5 mg. Per l’elenco completo degli eccipienti, vedere paragrafo 6.1.
3. FORMA FARMACEUTICA
Compressa a rilascio modificato.
Le compresse sono rotonde (diametro 8 mm), convesse e rosa.
4. INFORMAZIONI CLINICHE
4.1 Indicazioni terapeutiche
Trattamento dell’insufficienza surrenalica negli adulti.
4.2 Posologia e modo di somministrazione Posologia
Plenadren si usa come terapia di mantenimento. Le dosi sostitutive orali devono essere personalizzate a seconda della risposta clinica. La dose di mai/emmen^ comune e di 20 - 30 mg di Plenadren al giorno, somministrata una volta al giorno . l m 'ttn o. Nei pazienti in cui si riscontri ancora una produzione di cortisolo endogeno potrebbe e. sere sufTiciente una dose inferiore. 40 mg e la piú alta dose di mantenimento di Plenadren studiata. Si deve utilizzare la dose di mantenimento piú bassa possibile. Qualora l’organismo ra esr sto a stress fisico e/o mentale eccessivo, il paziente potrebbe aver bisogno di un’ulteriore sostituzione di compresse di idrocortisone a rilascio immediato soprattutto nel pomeriggio/alla ^era, vedere anche il paragrafo ‘Uso nelle malattie intercorrenti’ nel quale si descrivono altr-' mrtedi per aumentare temporaneamente la dose di idrocortisone.
Passaggio dal trattamento glucocorticoide orale convenzionale a Plenadren
Quando il paziente passa da una terapia sostitutiva convenzionale di idrocortisone orale somministrata tre volte al sioi. o a Plen a^en, si puo somministrare una dose giornaliera totale identica. A causa della minore bictispomMlita della dose giornaliera di Plenadren rispetto a quella delle compresse convenzionali di idrocortisone somministrate tre volte al giorno (vedere paragrafo 5.2), e necessario monitorare ia risposta clinica e potrebbe essere opportuno personalizzare ulteriormente la dose. Il passaggio del paziente da compresse di idrocortisone somministrate due volte al giorno, cortisone acetato o glucorticoidi sintetici a Plenadren non e stato studiato, ma in questi casi si raccomanda il passaggio a una dose giornaliera idrocortisone equivalente di Plenadren; potrebbe essere necessario personalizzare ulteriormente la dose.
Uso nelle malattie intercorrenti
Nel corso di malattie intercorrenti, non si deve assolutamente ignorare il rischio di sviluppare insufficienza surrenalica acuta.
Nei casi piú gravi, si rende necessario un aumento immediate della dose e la somministrazione orale di idrocortisone dev’essere sostituita dal trattamento parenterale. La somministrazione parenterale di idrocortisone e giustificata durante episodi transitori della malattia, come gravi infezioni, in particolare gastroenterite associata a vomito e/o diarrea, febbre alta di qualsiasi eziologia o stress fisico intenso, per esempio nel caso di gravi incidenti e intervento chirurgico in anestesia generale, vedere paragrafo 4.4.
Nei casi meno gravi quando non sia necessaria la somministrazione parenterale di idrocortisone, per esempio infezioni di basso grado, febbre di qualsiasi eziologia e situazioni di stress come procedure chirurgiche minori, la dose sostitutiva giornaliera orale normale dev’essere aumentata temporaneamente; la dose giornaliera totale di Plenadren dev’essere aumentata somministrando la dose di mantenimento due o tre volte al giorno con intervalli di 8 ± 2 ore (aumentando il numero delle somministrazioni, senza aumentare la dose del mattino). Questo regime e stato documentato in piú di 300 episodi di malattie intercorrenti nell’ambito del programma di studio clinico. A discrezione del medico curante, si possono somministrare compresse di idrocortisone a rilascio immediato invece di Plenadren oppure le stesse possono essere aggiunte a Plenadren. L’aumento della dose di idrocortisone in un’unica somministrazione aumenta l’esposizione plasmatica complessiva al ortis olo in maniera meno che proporzionale, vedere paragrafo 5.2. Una volta che l’episodio di malttia intercorrente si e concluso, il paziente puo tornare alla dose di mantenimento normalf di Ple nadren.
Popolazioni speciali
Anziani
Nel caso di basso peso corporeo correlate all’eta, si raccomanda il nonitoraggio della risposta clinica; potrebbe essere necessario l’aggiustamento della dose a una dose inferiore, vedere anche paragrafo 5.2.
Insufficienza renale
Non e necessario alcun aggiustamento della dose nei pazienti con insufficienza renale da lieve a moderata. Nei pazienti con insufficienza renale grave, si ra'con anda il monitoraggio della risposta clinica e potrebbe essere necessario l’aggiustamento della dose; vedere paragrafo 5.2.
Insufficienza epatica
Non e necessario alcun aggiustamento della dose nei pazienti con insufficienza epatica da lieve a moderata. Nei pazienti con insufficienza epatica grave, la massa epatica funzionale diminuisce e di conseguenza diminuisce la capacita di metabolizzazione dell’idrocortisone. Quindi si raccomanda il monitoraggio della risposta clinica, e potrebbe essere necessario l’aggiustamento della dose; vedere paragrafo 5.2.
Popolazione pediat"ica
La sicurezza e l’efficacia di Plenadren nei bambini/negli adolescenti di etá inferiore ai 18 anni non sono state ancora stabilite. Non ci sono dati disponibili.
Modo di somministrazione
I pazienti r evoo esseu istruiti ad assumere Plenadren oralmente con un bicchiere d’acqua al momento del risveglio, almeno 30 minuti prima di assumere cibo, preferibilmente in posizione eretta e tra le 6.00 e .. 8.00 del m attino. La compressa deve essere deglutita intera, senza dividerla, romperla o frantumarla. Se e necessario somministrare piú di una dose al giorno, la dose del mattino dev’essere somministrata secondo le istruzioni, e quelle supplementari somministrate successivamente durante il giorno possono essere assunte con o senza cibo.
4.3 Controindicazioni
Ipersensibilitá al principio attivo o ad uno qualsiasi degli eccipienti elencati al paragrafo 6.1.
4.4 Avvertenze speciali e precauzioni d’impiego
Infezioni concomitanti
In caso di insufficienza surrenalica acuta, ricorrere alla somministrazione parenterale di idrocortisone a dosi elevate, con soluzione di cloruro di sodio 9 mg/ml (0,9%) per iniezione.
In caso di malattie transitorie, per esempio infezioni di basso grado, febbre di qualsiasi eziologia e situazioni di stress come procedure chirurgiche minori, la dose sostitutiva giornaliera dev’essere aumentata temporaneamente, vedere paragrafo 4.2, “Uso nelle malattie intercorrenti” . Il paziente dev’essere adeguatamente informato su come comportarsi in queste situazioni, e gli dev’essere raccomandato di consultare un medico qualora si verifichi un peggioramento acuto; soprattutto nel caso di gastroenterite, vomito e/o diarrea che provocano perdita di liquidi e sali, nonché l’assorbimento inadeguato di idrocortisone orale.
I pazienti con insufficienza surrenalica e concomitanti infezioni retrovirali, come l’HIV, hanno bisogno di un attento aggiustamento della dose a causa della potenziale interazione con i medicinali antiretrovirali e di una dose piú alta di idrocortisone a causa dell’infezione.
Gli studi scientifici non confermano gli effetti immunosoppressivi dell’idrocortisone nelle dosi utilizzate per la terapia sostitutiva in pazienti con insufficienza surrenalica. Quindi, non vi e ragione di credere che le dosi sostitutive di idrocortisone aggravino un’eventuale infezione sistemica o l’esito di tale infezione. Inoltre, non vi e motivo di credere che le dosi di idrocortisone utilizzate per la terapia sostitutiva nell’insufficienza surrenalica possano ridurre la risposta ai vaccini e aumentare il rischio di infezioni generalizzate con vaccini vivi.
Svuotamento gastrico e disturbi della motilita
Le compresse a rilascio modificato non sono raccomandate in pazienti c'n aumentata motilita gastrointestinale, ossia diarrea cronica, per il rischio di alterata esposizione al cortisolo; a questi pazienti si devono somministrare altre formulazioni di idrocortisone. Non esistono dati su pazienti in cui siano stati confermati un rallentato svuotamento gastrico o disordini con ridotta motilita. Nei pazienti in cui si osservino tali condizioni si deve monitorare la risposta clinica.
Assunzione di dosi di idrocortisone piu alte del normale
Alte dosi (sovrafisiologiche) di idrocortisone possono provocare l’aumento della pressione del sangue, ritenzione di sali e liquidi, e maggiore escrezione di potassio. Il trattamento di lungo periodo con dosi di idrocortisone piú alte di quelle fisiologiche puo dar luogo a caratteristiche cliniche che assomigliano alla sindrome di Cushing con aumento dell’adiposita, obesita addominale, ipertensione e diabete, e quindi aumentare il rischio di morbilita cardiovascolare e mortalita.
L’eta avanzata e il basso indice b m assa corporea sono noti fattori di rischio per comuni reazioni avverse delle dosi farmacologiche di glucocorticoidi, come l’osteoporosi, l’assottigliamento della pelle, il diabete mellito, l’ipertensione e la maggiore predisposizione alle infezioni.
Tutti i glucocorticoidi aumentano l’escrezione del calcio e riducono il tasso di rimodellamento osseo. Si e osservato che nb pa- enti con insufficienza surrenalica sottoposti a terapia sostitutiva di lungo periodo con glucocorticoidi si registra una ridotta densita minerale ossea.
L’uso prolungato di alte dosi di glucocorticoidi potrebbe dar luogo a cataratta subcapsulare posteriore e glaucoma c v possibili danni ai nervi ottici. Tali effetti non sono stati segnalati nei pazienti sottoposti a terapia sostitutiva con glucocorticoidi con le dosi impiegate nell’insufficienza surrenalica.
Con i glucocorticoidi sistemici possono verificarsi reazioni avverse di tipo psichiatrico. Questo puo avvenire all’inizio del trattamento e durante gli aggiustamenti delle dosi. I rischi possono essere piú alti quando si somministrano alte dosi. Gran parte delle reazioni si risolvono dopo la riduzione della dose, benché possa essere necessario un trattamento specifico.
Funzionalita della tiroide
I pazienti con insufficienza surrenalica devono essere monitorati per accertare un’eventuale disfunzione della tiroide, poiché sia l’ipotiroidismo che l’ipertiroidismo possono esercitare una sensibile influenza sull’esposizione all’idrocortisone somministrato.
Il trattamento dell’insufficienza surrenalica primaria spesso giustifica l’aggiunta di un mineralcorticoide.
4.5 Interazione con altri medicinali ed altre forme d’interazione
Le seguenti interazioni dell’idrocortisone sono state riportate dopo la somministrazione di dosi terapeutiche di glucocorticoidi.
Potenti induttori del CYP 3A4 come la fenitoina, la rifabutina, la carbamazepina, i barbiturici, la rifampicina, l’iperico e induttori meno potenti come i medicinali antiretrovirali, efavirenz e nevirapina possono favorire la clearance metabolica del cortisolo, ridurre l’emivita terminale e quindi ridurre i livelli circolanti e aumentare le fluttuazioni del cortisolo (a causa della piú breve emivita term:"ale). Di conseguenza potrebbe essere necessario un aggiustamento della dose di idrocortisone.
Potenti inibitori del CYP 3A4 come il ketoconazolo, l’itraconazolo, il posaconazolo, il voriconazolo, l’eritromicina, la telitromicina, la claritromicina, il ritonavir e il succo di pompelmo possono inibire il metabolismo dell’idrocortisone, e aumentare quindi i livelli ematici. Durante il trattamento profilattico di lungo periodo con uno degli antibiotici, e opportuno considerare l’aggiustamento della dose di idrocortisone.
L’effetto dei corticosteroidi puo ridursi per 3-4 giorni dopo il trattamento con mifepristone.
E necessario monitorare la risposta clinica dei pazienti a cui si somministrano medicinali che influiscono sullo svuotamento gastrico e sulla motilitá, vedere anche paragrafo 4.4.
4.6 Fertilita, gravidanza e allattamento
Gravidanza
Plenadren puo essere usato durante la gravidan. a. Non v ;ono indicazioni che la terapia sostitutiva con idrocortisone nelle donne in gravidanza con insufficienza surrenalica sia associata a esiti avversi per la madre e/o il feto. L’insufficienza surrenalica non trattata durante la gravidanza si associa a un esito negativo per la madre e il feto, ed e percio importante continuare il trattamento durante la gravidanza.
Gli studi riproduttivi sugli animali dimostrano che i glucocorticoidi possono provocare anomalie fetali e tossicitá riproduttiva (vedere paragrafo 5.3).
La dose di idrocortisone dev’essere attentamente monitorata durante la gravidanza nelle donne con insufficienza surrenalica. Si raccomanda di dosare la somministrazione sulla base della risposta clinica individu ale.
Allatt ^nu
L’idrocortisone e escreto nel latte materno. Plenadren puo essere usato durante l’allattamento al seno. E improbabile che le dosi di idrocortisone usate come terapia sostitutiva abbiano un impatto clim/mente sif lificativo sul bambino. I bambini di madri che assumono alte dosi di glucocorticoidi sistemici per periodi prolungati possono essere a rischio di soppressione surrenalica.
Fertilitá
E stata dimostrata una ridotta paritá nelle pazienti con insufficienza surrenalica, molto probabilmente a causa della malattia di fondo, ma non vi sono indicazioni che l’idrocortisone somministrato in dosi per terapia sostitutiva influisca sulla fertilitá.
4.7 Effetti sulla capacita di guidare veicoli e sull’uso di macchinari
Plenadren altera lievemente la capacitá di guidare veicoli o di usare macchinari. Sono stati riportati affaticamento ed episodi di vertigini di breve durata.
L’insufficienza surrenalica non trattata o trattata con inadeguata terapia sostitutiva puo alterare la capacitá di guidare veicoli e di usare macchinari.
4.8 Effetti indesiderati
Sintesi del profilo di sicurezza
L’idrocortisone viene somministrato come terapia sostitutiva al fine di ripristinare livelli normali di cortisolo. Il profilo delle reazioni avverse nel trattamento dell’insufficienza surrenalica quindi non e comparabile a quello di altre condizioni che richiedono dosi molto piú alte di glucocorticoidi somministrate oralmente o per via parenterale.
Complessivamente, in uno studio di 12 settimane, la frequenza e il tipo delle reazioni avverse ’ran simili per compresse di Plenadren a rilascio modificato somministrate una volta al giorno ■ comtres:e di idrocortisone somministrate tre volte al giorno. C’e stato un aumento iniziale nella frequenza delle reazioni avverse approssimativamente in un paziente su cinque, osservati fino a otto settimane dopo essere passati per la prima volta da compresse convenzionali di idrocortisone somministrate tre volte al giorno a compresse a rilascio modificato somministrate una volta al giorno. Tuttavia queste reazioni avverse (dolori addominali, diarrea, nausea e affaticamento) sono lievi o mode rate, +ransitorie e di breve durata ma potrebbero rendersi necessari un aggiustamento della dose o medicinali concomitanti supplementary Vedere anche paragrafo 4.2. L’affaticamento e stato riportato tra gli effetti molto comuni.
Elenco tabulato delle reazioni avverse
80 pazienti in totale (173 pazienti-anni di dati) sono stati rat.ati ’on Plenadren in studi clinici. Le reazioni avverse, osservate in uno studio controllato di tre mesi Nd elencate di seguito, sono classificate in base alla frequenza e alla Classificazione Sistemica Organica:
molto comune (> 1/10); comune (>1/100 e <1/10); non comune (>1/1.000 e <1/100); rare (>1/10.000 e < 1/1.000); molto raro (< 1/10.000); non noto (la frequenza non puo essere definita dai dati disponibili).
Infezioni e infestazioni
Comune: Gastroenterite, infezioni del tratto respiratorio superiore, infezione virale.
Patologie del sistema nervoso Comune: Sedazione, vertigini.
Patologie dell’occhio Comune: Secchezza dell’occhio.
Patologie gastrointestinali
Comune: Esofagite, nausea, dolore addominale superiore, erosione dentale.
Patologie della cute e del tessuto sottocutaneo Com e: Eruzf ie pruriginosa.
Patologie del sistema muscoloscheletrico e del tessuto connettivo Comune: Gonfiore delle articolazioni.
Patologie sistemiche e condizioni relative alla sede di somministrazione Molto comune: Affaticamento.
Esami diagnostici
Comune: Calo dell’HDL, aumento ponderale.
Inoltre sono state segnalate le seguenti reazioni avverse per altri medicinali con idrocortisone somministrati con indicazioni diverse da quelle previste per la terapia sostitutiva per insufficienza surrenalica a dosi piú alte (le frequenze non sono note).
Disturbi del sistema immunitario
Attivazione dell’infezione (tubercolosi, infezioni fungine e virali, herpes incluso).
Patologie endocrine
Induzione dell’intolleranza al glucosio o del diabete mellito.
Disturbi del metabolismo e della nutrizione
Ritenzione idrica e di sodio e tendenza all’edema, ipertensione, ipopotassiemia.
Disturbi psichiatrici Euforia e psicosi, insonnia.
Patologie dell’occhio
Incremento della pressione intraoculare e cataratta.
Patologie gastrointestinali
Dispepsia e peggioramento dell’ulcera gastrica esistente.
Patologie della cute e del tessuto sottocutaneo
Sintomi simili alla sindrome di Cushing, stria, ecchimosi, acne e irsutismo, cicatrizzazione rallentata.
Patologie del sistema muscoloscheletrico e del tessuto connettiv o Osteoporosi con fratture spontanee.
Segnalazione delle reazioni avverse sospette
La segnalazione delle reazioni avverse sospett' ch’ si * erificano dopo l’autorizzazione del medicinale e importante, in quanto permette un m on/ora ggu continuo del rapporto beneficio/rischio del medicinale. Agli operatori sanitari e richiesto di segnalare qualsiasi reazione avversa sospetta tramite il sistema nazionale di segnalazione riportato nell’Allegato V*.
4.9 Sovradosaggio
Si segnalano raramente casi di tossicitá acuta e/o morte in seguito a sovradosaggio di idrocortisone. Non esiste alcun antido o. i sin tomi > ossono variare dall’eccitazione/agitazione alla mania o alla psicosi. Tra i segni si risco’t ano a'ta p^ssione del sangue, elevati livelli plasmatici del glucosio e ipopotassiemia. Il trattamento probabilmente non e indicato per reazioni dovute ad avvelenamento cronico, a meno che la condizione del ">aJente non lo renda insolitamente predisposto ad effetti avversi dell’idrocortisone. Nel qual caso, il trattamento sintomatico diviene necessario.
5. PROPRI ETA FARMACOLOGICHE
5.1 Proprieta farmacodinamiche
Categoria farmacoterapeutica: Corticosteroidi per uso sistemico, glucocorticoidi, codice ATC: H02AB09.
Azione farmacodinamica
L’idrocortisone e un glucocorticoide ed e la forma sintetica del cortisolo prodotto a livello endogeno.
I glucocorticoidi sono steroidi importanti per il metabolismo intermedio, la funzione immunitaria, il sistema muscoloscheletrico e il tessuto connettivo e il cervello. Il cortisolo e il principale glucocorticoide secreto dalla corteccia surrenale.
I glucocorticoidi naturali (idrocortisone e cortisolo), che hanno anche proprietá di ritenzione di sali, vengono usati come terapia sostitutiva nell’insufficienza surrenalica. Vengono usati anche per i loro potenti effetti antinfiammatori nei disturbi di molti organi. I glucocorticoidi provocano effetti metabolici profondi e vari. Inoltre essi modificano le risposte immunitarie dell’organismo a diversi stimoli.
Efficacia clinica
Lo studio cardine e stato uno studio randomizzato, multicentrico, crossover, eseguito in due periodi da 12 settimane su 64 pazienti con insufficienza surrenalica primaria, 11 dei quali con diabete mellito concomitante e 11 con ipertensione. Lo studio ha messo a confronto le compresse a rilascio modificato somministrate una volta al giorno con le compresse convenzionali somministrate tre volte al giorno utilizzando la stessa dose giornaliera di idrocortisone (da 20 a 40 mg).
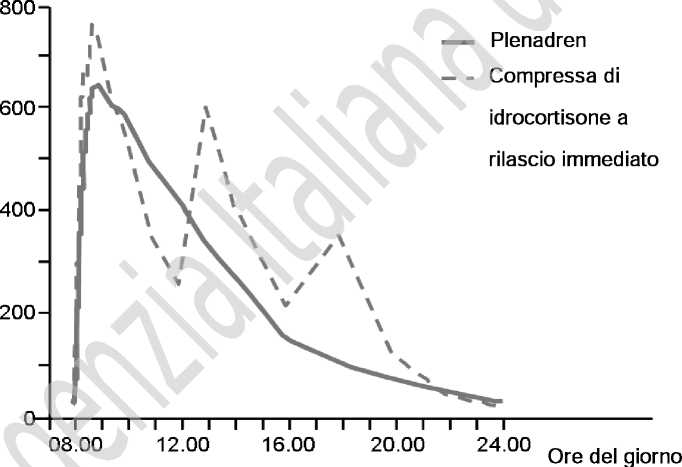
Rispetto alle compresse convenzionali somministrate tre volte al giorno, le compressf a r;1as",io modificato somministrate una volta al giorno hanno dato luogo a un aumento dell’esposizione al cortisolo durante le prime quattro ore dopo l’assunzione al mattino, ma una ridotta esposizione nel tardo pomeriggio/alla sera e nelle 24 ore (Figura 1).
Figura 1. Concentrazione media di cortisolo serico osservata verso empo in egu;to alla somministrazione di dosi singole e multiple in pazienti con insufficient , su ren dica primaria (n=62) dopo la somministrazione orale di Plenadren, dato una volta al gorno, e di idrocortisone, tre volte al giorno.
Concentrazione di cortisolo (nM)
5.2 Proprieta farmacocinetiche
Assorbimento
In seguito a somministrazione orale, l’idrocortisone e assorbito bene e rapidamente dal tratto gastrointestinale ed e stato riportato un assorbimento superiore al 95% per una dose orale da 20 mg (compresse). L’idrocortisone e un farmaco di classe II secondo il sistema di classificazione biofarmaceutica (BCS) con un’alta permeabilitá intestinale e un basso tasso di dissoluzione, soprattutto a dosi piú alte. La compressa a rilascio modificato ha uno strato di rivestimento esterno che consente l’immediato rilascio del farmaco e un nucleo a rilascio prolungato. La parte a rilascio immediato consente un rapido avvio dell’assorbimento e la parte a rilascio prolungato offre un profilo plasmatico piú esteso del cortisolo. La biodisponibilitá (AUC0-24h) e del 20% inferiore nella compressa a rilascio modificato rispetto alla stessa dose giomaliera di idrocortisone somministrata sotto forma di compresse convenzionali tre volte al giorno. Quando la dose orale viene aumentata l’esposizione plasmatica complessiva al cortisolo aumenta in maniera meno che proporzionale. L’esposizione aumenta di tre volte quando la dose di idrocortisone a rilascio modificato aumenta da 5 mg a 20 mg.
La velocitá di assorbimento dell’idrocortisone e ridotta dopo l’assunzione di cibo risultando in un ritardo nel tempo di comparsa della concentrazione plasmatica massima da una media di meno di 1 ora a piú di 2,5 ore. D’altro canto, l’entitá dell’assorbimento e della biodisponibilitá e stata superiore del 30% circa per la compressa da 20 mg dopo l’assunzione di cibo rispetto chea digiuno, e non e stato osservato alcun mancato assorbimento né dose dumping.
Distribuzione
Nel plasma, il cortisolo e legato alla globulina legante i corticosteroidi (CBG o transcortina) e all’albumina. Il legame e del 90% circa.
Eliminazione
E stato riportato che l’emivita terminale e pari a 1,5 ore circa in seguito a dosag ,i ■ endovenoso e orale di compresse di idrocortisone. L’emivita terminale del cortisolo in seguito alla somministrazione di Plenadren e stata di 3 ore circa, con formula a rilascio controllato. Questa emivita terminale e simile alla farmacocinetica del cortisolo endogeno che e anche con secrezio’ ' controllata.
L’idrocortisone (cortisolo) e un farmaco lipofilico che viene eliminato completamente attraverso il metabolismo con una bassa clearance e di conseguenza con bassi tassi di estrazione intestinale ed epatica.
L’idrocortisone viene eliminato completamente per via metabolica dagli enzimi 11BHSD tipo 1 e tipo 2 e da CYP 3A4 nel fegato e nel tessuto periferico. Il CYP 3A4 partecipa alla clearance del cortisolo mediante la formazione di 6p-idrossicortisolo che viene escreto nell’urina. Si prevede che il trasporto del cortisolo attraverso le membrane venga me^ iato ’ss” aalmente dalla diffusione passiva e quindi le clearance renali e biliari sono trascurab- i.
Popolazioni speciali
Insufficienza renale
Una piccola quantitá di cortisolo viene escreta nell’urina senza alcuna modifica (<0,5% della produzione giomaliera); cio significa che il cortisolo viene eliminato completamente per via metabolica. Poiché una grave :nsufficienza renale puo influire sui medicinali eliminati completamente attraverso il metabolismo, potrebbe essere necessario un aggiustamento della dose.
Insufficienza etatica
Non e stato effettuato alcuno studio nei pazienti con insufficienza epatica, ma i dati disponibili in letteratura per l’idrocortisone mostrano che non e necessario alcun aggiustamento della dose . JLimuffiLenza epatica da lieve a moderata. Nel caso di grave insufficienza epatica, la massa epatica funzi ^ale diminuisce e quindi diminuisce la capacitá di metabolizzazione dell’idrocortisone. Cio potrebbe rendere necessaria una personalizzazione della dose.
Popolazione pediatrica
Non sono disponibili dati farmacocinetici per bambini o adolescenti.
5.3 Dati preclinici di sicurezza
Gli esperimenti condotti sugli animali hanno dimostrato che l’esposizione prenatale a dosi molto alte di glucocorticoidi puo indurre malformazioni (palatoschisi, malformazioni scheletriche). Gli studi sugli animali hanno dimostrato altresi che l’esposizione prenatale a dosi di glucocorticoidi alte (ma inferiori a dosi teratogene) puo essere associata a un maggiore rischio di ritardo della crescita intrauterina, patologie cardiovascolari in etá adulta e modifiche permanenti nella densitá del recettore dei glucocorticoidi, nel turnover dei neurotrasmettitori, e nel comportamento.
6. INFORMAZIONI FARMACEUTICHE
6.1 Elenco degli eccipienti
Nucleo Ipromellosa
Cellulosa microcristallina Amido pregelatinizzato (di mais)
Silice colloidale anidra Magnesio stearato
Rivestimento Macrogol (3350)
Alcol polivinilico Talco
Titanio diossido (E171)
Ossido di ferro rosso (E172)
Ossido di ferro giallo (E 172)
Ossido di ferro nero (E172)
6.2 Incompatibilita

Non pertinente.
6.3 Periodo di validita
3 anni
6.4 Precauzioni particolar per la c'nservazione
Questo medicinale non richiede alcana condizione particolare di conservazione.
6.5 Natura e contenuto dt' contenitore
Flaconi HDPE con tappo a vite PP contenenti 50 compresse a rilascio modificato.
Scatola di cartne con^enente 1 flacone da 50 compresse a rilascio modificato e confezioni multiple contenenti 100, 150 e 300 compresse a rilascio modificato (2, 3 e 6 scatole da 50 compresse a rilascio modificato).
E possibile che non tutte le confezioni siano commercializzate.
6.6 Precauzioni particolari per lo smaltimento
Il medicinale non utilizzato e i rifiuti derivati da tale medicinale devono essere smaltiti in conformitá della normativa locale vigente.
7. TITOLARE DELL’AUTORIZZAZIONE ALL’IMMISSIONE IN COMMERCIO
ViroPharma SPRL Rue Montoyer 47
B - 1000 Bruxelles Belgio
8. NUMERO(I) DELL’AUTORIZZAZIONE ALL’IMMISSIONE IN COMMERCIO
EU/1/11/715/001
EU/1/11/715/003
EU/1/11/715/004
EU/1/11/715/005
9. DATA DELLA PRIMA AUTORIZZAZIONE/RINNOVO DELL’AUTOR' zZ AZIONE
Data della prima autorizzazione: 3 novembre 2011
10. DATA DI REVISIONE DEL TESTO
{MM/AAAA}
Informazioni piú dettagliate su questo medicinale sono disponibili sul sito web dell’Agenzia europea dei medicinali http://www.ema.europa.eu.


1. DENOMINAZIONE DEL MEDICINALE
Plenadren 20 mg compresse a rilascio modificato
2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
Ogni compressa a rilascio modificato contiene: idrocortisone 20 mg.
Per l’elenco completo degli eccipienti, vedere paragrafo 6.1.
3. FORMA FARMACEUTICA
Compressa a rilascio modificato.
Le compresse sono rotonde (diametro 8 mm), convesse e bianche.
4. INFORMAZIONI CLINICHE
4.1 Indicazioni terapeutiche
Trattamento dell’insufficienza surrenalica negli adulti.
4.2 Posologia e modo di somministrazione Posologia
Plenadren si usa come terapia di mantenimento. Le dosi sostitutive orali devono essere personalizzate a seconda della risposta clinica. La dose di mantenimento comune e di 20 - 30 mg di Plenadren al giorno, somministrata una volta al giorno al mattino. Nei pazienti in cui si riscontri ancora una produzione di cortisolo endogeno potrebbe essere sufficiente una dose inferiore. 40 mg e la piú alta dose di mantenimento di Plenadren studiata. Si deve utilizzare la dose di mantenimento piú bassa possibile. Qualora l’organism o sia esp osto a stress fisico e/o mentale eccessivo, il paziente potrebbe aver bisogno di un’ulteriore sostituzione di compresse di idrocortisone a rilascio immediato soprattutto nel pom erig .o/alla seia vedere anche il paragrafo ‘Uso nelle malattie intercorrenti’ nel quale si descrivono altri metodi per aumentare temporaneamente la dose di idrocortisone.
Passaggio dal trattamento glucocorticoide orale convenzionale a Plenadren
Quando il paziente passa da una terapia sostitutiva convenzionale di idrocortisone orale somministrata tre volte al gior no A Plenadren, si puo somministrare una dose giornaliera totale identica. A causa della minore biodisponibilitá della dose giornaliera di Plenadren rispetto a quella delle compresse . vnvenňonJi di idrocortisone somministrate tre volte al giorno (vedere paragrafo 5.2), e necessario moniu'raie la lisposta clinica e potrebbe essere opportuno personalizzare ulteriormente la dose. Il passaggio del paziente da compresse di idrocortisone somministrate due volte al giorno, cortisone acetato o gluc rticoidi sintetici a Plenadren non e stato studiato, ma in questi casi si raccomanda il passaggio a una dose giornaliera idrocortisone equivalente di Plenadren; potrebbe essere necessario personalizzare ulteriormente la dose.
Uso nelle malattie intercorrenti
Nel corso di malattie intercorrenti, non si deve assolutamente ignorare il rischio di sviluppare insufficienza surrenalica acuta.
Nei casi piú gravi, si rende necessario un aumento immediate della dose e la somministrazione orale di idrocortisone dev’essere sostituita dal trattamento parenterale. La somministrazione parenterale di idrocortisone e giustificata durante episodi transitori della malattia, come gravi infezioni, in particolare gastroenterite associata a vomito e/o diarrea, febbre alta di qualsiasi eziologia o stress fisico intenso, per esempio nel caso di gravi incidenti e intervento chirurgico in anestesia generale, vedere paragrafo 4.4.
Nei casi meno gravi quando non sia necessaria la somministrazione parenterale di idrocortisone, per esempio infezioni di basso grado, febbre di qualsiasi eziologia e situazioni di stress come procedure chirurgiche minori, la dose sostitutiva giornaliera orale normale dev’essere aumentata temporaneamente; la dose giornaliera totale di Plenadren dev’essere aumentata somministrando la dose di mantenimento due o tre volte al giorno con intervalli di 8 ± 2 ore (aumentando il numero delle somministrazioni, senza aumentare la dose del mattino). Questo regime e stato documentato in piú di 300 episodi di malattie intercorrenti nell’ambito del programma di studio clinico. A discrezione del medico curante, si possono somministrare compresse di idrocortisone a rilascio immediato invece di Plenadren oppure le stesse possono essere aggiunte a Plenadren. L’aumento della dose di idrocortisone in un’unica somministrazione aumenta l’esposizione plasmatica complessiva al ortmlo in maniera meno che proporzionale, vedere paragrafo 5.2. Una volta che l’episodio di mal ttia intercorrente si e concluso, il paziente puo tornare alla dose di mantenimento normalf di Ple nadren.
Popolazioni speciali
Anziani
Nel caso di basso peso corporeo correlato all’eta, si raccomanda il monitoraggio della risposta clinica; potrebbe essere necessario l’aggiustamento della dose a una dose inferiore, vedere anche paragrafo 5.2.
Insufficienza renale
Non e necessario alcun aggiustamento della dose nei pazienti con insufficienza renale da lieve a moderata. Nei pazienti con insufficienza renale grave, si ra'con anda il monitoraggio della risposta clinica e potrebbe essere necessario l’aggiustamento della dose; vedere paragrafo 5.2.
Insufficienza epatica
Non e necessario alcun aggiustamento della dose nei pazienti con insufficienza epatica da lieve a moderata. Nei pazienti con insufficienza epatica grave, la massa epatica funzionale diminuisce e di conseguenza diminuisce la capacita di metabolizzazione dell’idrocortisone. Quindi si raccomanda il monitoraggio della risposta clinica, e potrebbe essere necessario l’aggiustamento della dose; vedere paragrafo 5.2.
Popolazione pediat"ica
La sicurezza e l’efficacia di Plenadren nei bambini/negli adolescenti di etá inferiore ai 18 anni non sono state ancora stabilite. Non ci sono dati disponibili.
Modo di somministrazione
I pazienti r evoo esseu istruiti ad assumere Plenadren oralmente con un bicchiere d’acqua al momento del risveglio, almeno 30 minuti prima di assumere cibo, preferibilmente in posizione eretta e tra le 6.00 e . . 8.00 del m attino. La compressa deve essere deglutita intera, senza dividerla, romperla o frantumarla. Se e necessario somministrare piú di una dose al giorno, la dose del mattino dev’essere somministrata secondo le istruzioni, e quelle supplementari somministrate successivamente durante il giorno possono essere assunte con o senza cibo.
4.3 Controindicazioni
Ipersensibilitá al principio attivo o ad uno qualsiasi degli eccipienti elencati al paragrafo 6.1
4.4 Avvertenze speciali e precauzioni d’impiego
Infezioni concomitanti
In caso di insufficienza surrenalica acuta, ricorrere alla somministrazione parenterale di idrocortisone a dosi elevate, con soluzione di cloruro di sodio 9 mg/ml (0,9%) per iniezione.
In caso di malattie transitorie, per esempio infezioni di basso grado, febbre di qualsiasi eziologia e situazioni di stress come procedure chirurgiche minori, la dose sostitutiva giornaliera dev’essere aumentata temporaneamente, vedere paragrafo 4.2, “Uso nelle malattie intercorrenti” . Il paziente dev’essere adeguatamente informato su come comportarsi in queste situazioni, e gli dev’essere raccomandato di consultare un medico qualora si verifichi un peggioramento acuto; soprattutto nel caso di gastroenterite, vomito e/o diarrea che provocano perdita di liquidi e sali, nonché l’assorbimento inadeguato di idrocortisone orale.
I pazienti con insufficienza surrenalica e concomitanti infezioni retrovirali, come l’HIV, hanno bisogno di un attento aggiustamento della dose a causa della potenziale interazione con i medicinali antiretrovirali e di una dose piú alta di idrocortisone a causa dell’infezione.
Gli studi scientifici non confermano gli effetti immunosoppressivi dell’idrocortisone nelle dosi utilizzate per la terapia sostitutiva in pazienti con insufficienza surrenalica. Quindi, non vi e ragione di credere che le dosi sostitutive di idrocortisone aggravino un’eventuale infezione sistemica o l’esito di tale infezione. Inoltre, non vi e motivo di credere che le dosi di idrocortisone utilizzate per la terapia sostitutiva nell’insufficienza surrenalica possano ridurre la risposta ai vaccini e aumentare il rischio di infezioni generalizzate con vaccini vivi.
Svuotamento gastrico e disturbi della motilita
Le compresse a rilascio modificato non sono raccomandate in pazienti c'n aumentata motilita gastrointestinale, ossia diarrea cronica, per il rischio di alterata esposizione al cortisolo; a questi pazienti si devono somministrare altre formulazioni di idrocortisone. Non esistono dati su pazienti in cui siano stati confermati un rallentato svuotamento gastrico o disordini con ridotta motilita. Nei pazienti in cui si osservino tali condizioni si deve monitorare la risposta clinica.
Assunzione di dosi di idrocortisone piu alte del normale
Alte dosi (sovrafisiologiche) di idrocortisone possono provocare l’aumento della pressione del sangue, ritenzione di sali e liquidi, e maggiore escrezione di potassio. Il trattamento di lungo periodo con dosi di idrocortisone piú alte di quelle fisiologiche puo dar luogo a caratteristiche cliniche che assomigliano alla sindrome di Cushing con aumento dell’adiposita, obesita addominale, ipertensione e diabete, e quindi aumentare il rischio di morbilita cardiovascolare e mortalita.
L’eta avanzata e il basso indice b m assa corporea sono noti fattori di rischio per comuni reazioni avverse delle dosi farmacologiche di glucocorticoidi, come l’osteoporosi, l’assottigliamento della pelle, il diabete mellito, l’ipertensione e la maggiore predisposizione alle infezioni.
Tutti i glucocorticoidi aumentano l’escrezione del calcio e riducono il tasso di rimodellamento osseo. Si e osservato che nb p a- enti con insufficienza surrenalica sottoposti a terapia sostitutiva di lungo periodo con glucocorticoidi si registra una ridotta densita minerale ossea.
L’uso prolungato di alte dosi di glucocorticoidi potrebbe dar luogo a cataratta subcapsulare posteriore e glau'on.a c on possibili danni ai nervi ottici. Tali effetti non sono stati segnalati nei pazienti sottoposti a terapia sostitutiva con glucocorticoidi con le dosi impiegate nell’insufficienza surrenalica.
Con i glucocorticoidi sistemici possono verificarsi reazioni avverse di tipo psichiatrico. Questo puo avvenire all’inizio del trattamento e durante gli aggiustamenti delle dosi. I rischi possono essere piú alti quando si somministrano alte dosi. Gran parte delle reazioni si risolvono dopo la riduzione della dose, benché possa essere necessario un trattamento specifico.
Funzionalita della tiroide
I pazienti con insufficienza surrenalica devono essere monitorati per accertare un’eventuale disfunzione della tiroide, poiché sia l’ipotiroidismo che l’ipertiroidismo possono esercitare una sensibile influenza sull’esposizione all’idrocortisone somministrato.
Il trattamento dell’insufficienza surrenalica primaria spesso giustifica l’aggiunta di un mineralcorticoide.
4.5 Interazione con altri medicinali ed altre forme d’interazione
Le seguenti interazioni dell’idrocortisone sono state riportate dopo la somministrazione di dosi terapeutiche di glucocorticoidi.
Potenti induttori del CYP 3A4 come la fenitoina, la rifabutina, la carbamazepina, i barbiturici, la rifampicina, l’iperico e induttori meno potenti come i medicinali antiretrovirali, efavirenz e nevirapina possono favorire la clearance metabolica del cortisolo, ridurre l’emivita terminale e quindi ridurre i livelli circolanti e aumentare le fluttuazioni del cortisolo (a causa della piú breve emivita term:"ale). Di conseguenza potrebbe essere necessario un aggiustamento della dose di idrocortisone.
Potenti inibitori del CYP 3A4 come il ketoconazolo, l’itraconazolo, il posaconazolo, il voriconazolo, l’eritromicina, la telitromicina, la claritromicina, il ritonavir e il succo di pompelmo possono inibire il metabolismo dell’idrocortisone, e aumentare quindi i livelli ematici. Durante il trattamento profilattico di lungo periodo con uno degli antibiotici, e opportuno considerare l’aggiustamento della dose di idrocortisone.
L’effetto dei corticosteroidi puo ridursi per 3-4 giorni dopo il trattamento con mifepristone.
E necessario monitorare la risposta clinica dei pazienti a cui si somministrano medicinali che influiscono sullo svuotamento gastrico e sulla motilitá, vedere anche paragrafo 4.4.
4.6 Fertilita, gravidanza e allattamento
Gravidanza
Plenadren puo essere usato durante la gravidan. a. Non v ;ono indicazioni che la terapia sostitutiva con idrocortisone nelle donne in gravidanza con insufficienza surrenalica sia associata a esiti avversi per la madre e/o il feto. L’insufficienza surrenalica non trattata durante la gravidanza si associa a un esito negativo per la madre e il feto, ed e percio importante continuare il trattamento durante la gravidanza.
Gli studi riproduttivi sugli animali dimostrano che i glucocorticoidi possono provocare anomalie fetali e tossicitá riproduttiva (vedere paragrafo 5.3).
La dose di idrocortisone dev’essere attentamente monitorata durante la gravidanza nelle donne con insufficienza surrenalica. Si raccomanda di dosare la somministrazione sulla base della risposta clinica individu ale.
Allatt ^nu
L’idrocortisone e escreto nel latte materno. Plenadren puo essere usato durante l’allattamento al seno. E improbabile che le dosi di idrocortisone usate come terapia sostitutiva abbiano un impatto clin^ mente sif íificativo sul bambino. I bambini di madri che assumono alte dosi di glucocorticoidi sistemici per periodi prolungati possono essere a rischio di soppressione surrenalica.
Fertilitá
E stata dimostrata una ridotta paritá nelle pazienti con insufficienza surrenalica, molto probabilmente a causa della malattia di fondo, ma non vi sono indicazioni che l’idrocortisone somministrato in dosi per terapia sostitutiva influisca sulla fertilitá.
4.7 Effetti sulla capacita di guidare veicoli e sull’uso di macchinari
Plenadren altera lievemente la capacitá di guidare veicoli o di usare macchinari. Sono stati riportati affaticamento ed episodi di vertigini di breve durata.
L’insufficienza surrenalica non trattata o trattata con inadeguata terapia sostitutiva puo alterare la capacitá di guidare veicoli e di usare macchinari.
4.8 Effetti indesiderati
Sintesi del profilo di sicurezza
L’idrocortisone viene somministrato come terapia sostitutiva al fine di ripristinare livelli normali di cortisolo. Il profilo delle reazioni avverse nel trattamento dell’insufficienza surrenalica quindi non e comparabile a quello di altre condizioni che richiedono dosi molto piú alte di glucocorticoidi somministrate oralmente o per via parenterale.
Complessivamente, in uno studio di 12 settimane, la frequenza e il tipo delle reazioni avverse erano simili per compresse di Plenadren a rilascio modificato somministrate una volta al giorno ' comp res;e di idrocortisone somministrate tre volte al giorno. C’e stato un aumento iniziale nella frequenza delle reazioni avverse approssimativamente in un paziente su cinque, osservati fino a otto settimane dopo essere passati per la prima volta da compresse convenzionali di idrocortisone somministrate tre volte al giorno a compresse a rilascio modificato somministrate una volta al giorno. Tuttavia queste reazioni avverse (dolori addominali, diarrea, nausea e affaticamento) sono lievi o mode rate, transitorie e di breve durata ma potrebbero rendersi necessari un aggiustamento della dose o medicinali concomitanti supplementari. Vedere anche paragrafo 4.2. L’affaticamento e stato riportato tra gli effetti molto comuni.
Elenco tabulato delle reazioni avverse
80 pazienti in totale (173 pazienti-anni di dati) sono stati rat.ati ’on Plenadren in studi clinici. Le reazioni avverse, osservate in uno studio controllato di tre mesi 'd elencate di seguito, sono classificate in base alla frequenza e alla Classificazione Sistemica Organica:
molto comune (>1/10); comune (>1/100 e <1/10); non comune (>1/1.000 e <1/100); rare (>1/10.000 e < 1/1.000); molto raro (< 1/10.000); non noto (la frequenza non puo essere definita dai dati disponibili).
Infezioni e infestazioni
Comune: Gastroenterite, infezioni del tratto respiratorio superiore, infezione virale.
Patologie del sistema nervoso Comune: Sedazione, vertigini.
Patologie dell’occhio Comune: Secchezza dell’occhio.
Patologie gastrointestinali
Comune: Esofagite, nausea, dolore addominale superiore, erosione dentale.
Patologie della cute e del tessuto sottocutaneo Comune: Eruzione pruriginosa.
Patologie del sistema muscoloscheletrico e del tessuto connettivo Comune: Gonfiore delle articolazioni.
Patologie sistemiche e condizioni relative alla sede di somministrazione Molto comune: Affaticamento.
Esami diagnostici
Comune: Calo dell’HDL, aumento ponderale.
Inoltre sono state segnalate le seguenti reazioni avverse per altri medicinali con idrocortisone somministrati con indicazioni diverse da quelle previste per la terapia sostitutiva per insufficienza surrenalica a dosi piú alte (le frequenze non sono note).
Disturbi del sistema immunitario
Attivazione dell’infezione (tubercolosi, infezioni fungine e virali, herpes incluso).
Patologie endocrine
Induzione dell’intolleranza al glucosio o del diabete mellito.
Disturbi del metabolismo e della nutrizione
Ritenzione idrica e di sodio e tendenza all’edema, ipertensione, ipopotassiemia.
Disturbi psichiatrici Euforia e psicosi, insonnia.
Patologie dell’occhio
Incremento della pressione intraoculare e cataratta.
Patologie gastrointestinali
Dispepsia e peggioramento dell’ulcera gastrica esistente.
Patologie della cute e del tessuto sottocutaneo
Sintomi simili alla sindrome di Cushing, stria, ecchimosi, acne e irsutismo, cicatrizzazione rallentata.
Patologie del sistema muscoloscheletrico e del tessuto connettiv o Osteoporosi con fratture spontanee.
Segnalazione delle reazioni avverse sospette
La segnalazione delle reazioni avverse sospeti' ch’ si * erificano dopo l’autorizzazione del medicinale e importante, in quanto permette un m on/ora ggio continuo del rapporto beneficio/rischio del medicinale. Agli operatori sanitari e richiesto di segnalare qualsiasi reazione avversa sospetta tramite il sistema nazionale di segnalazione riportato nell’Allegato V*.
4.9 Sovradosaggio
Si segnalano raramente casi di tossicitá acuta e/o morte in seguito a sovradosaggio di idrocortisone. Non esiste alcun antidr o. i sin tomi > ossono variare dall’eccitazione/agitazione alla mania o alla psicosi. Tra i segni si risco’t ano a'ta p^ssione del sangue, elevati livelli plasmatici del glucosio e ipopotassiemia. Il trattamento probabilmente non e indicato per reazioni dovute ad avvelenamento cronico, a meno che la condizione del ">aJente non lo renda insolitamente predisposto ad effetti avversi dell’idrocortisone. Nel qual caso, il trattamento sintomatico diviene necessario.
5. PROPRI ETA FARMACOLOGICHE
5.1 Proprieta farmacodinamiche
Categoria farmacoterapeutica: Corticosteroidi per uso sistemico, glucocorticoidi, codice ATC: H02AB09.
Azione farmacodinamica
L’idrocortisone e un glucocorticoide ed e la forma sintetica del cortisolo prodotto a livello endogeno.
I glucocorticoidi sono steroidi importanti per il metabolismo intermedio, la funzione immunitaria, il sistema muscoloscheletrico e il tessuto connettivo e il cervello. Il cortisolo e il principale glucocorticoide secreto dalla corteccia surrenale.
I glucocorticoidi naturali (idrocortisone e cortisolo), che hanno anche proprietá di ritenzione di Sali, vengono usati come terapia sostitutiva nell’insufficienza surrenalica. Vengono usati anche per i loro potenti effetti antinfiammatori nei disturbi di molti organi. I glucocorticoidi provocano effetti metabolici profondi e vari. Inoltre essi modificano le risposte immunitarie dell’organismo a diversi stimoli.
Efficacia clinica
Lo studio cardine e stato uno studio randomizzato, multicentrico, crossover, eseguito in due periodi da 12 settimane su 64 pazienti con insufficienza surrenalica primaria, 11 dei quali con diabete mellito concomitante e 11 con ipertensione. Lo studio ha messo a confronto le compresse a rilascio modificato somministrate una volta al giorno con le compresse convenzionali somministrate tre volte al giorno utilizzando la stessa dose giornaliera di idrocortisone (da 20 a 40 mg).
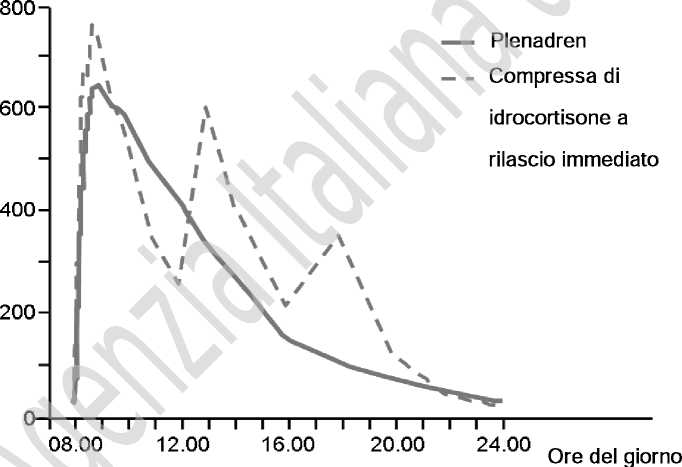
Rispetto alle compresse convenzionali somministrate tre volte al giorno, le compressf a fila-cio modificato somministrate una volta al giorno hanno dato luogo a un aumento dell’esposizione al cortisolo durante le prime quattro ore dopo l’assunzione al mattino, ma una ridotta esposizione nel tardo pomeriggio/alla sera e nelle 24 ore (Figura 1).
Figura 1. Concentrazione media di cortisolo sierico osservata vers, tempo F ^eg -ito alla somministrazione di dosi singole e multiple in pazienti con insufficient , su ren dica primaria (n=62) dopo la somministrazione orale di Plenadren, dato una volta al gorno, e di idrocortisone, tre volte al giorno.
Concentrazione di cortisolo (nM)
5.2 Proprieta farmacocinetiche
Assorbimento
In seguito a somministrazione orale, l’idrocortisone e assorbito bene e rapidamente dal tratto gastrointestinale ed e stato riportato un assorbimento superiore al 95% per una dose orale da 20 mg (compresse). L’idrocortisone e un farmaco di classe II secondo il sistema di classificazione biofarmaceutica (BCS) con un’alta permeabilitá intestinale e un basso tasso di dissoluzione, soprattutto a dosi piú alte. La compressa a rilascio modificato ha uno strato di rivestimento esterno che consente l’immediato rilascio del farmaco e un nucleo a rilascio prolungato. La parte a rilascio immediato consente un rapido avvio dell’assorbimento e la parte a rilascio prolungato offre un profilo plasmatico piú esteso del cortisolo. La biodisponibilita (AUC0_24h) e del 20% inferiore nella compressa a rilascio modificato rispetto alla stessa dose giornaliera di idrocortisone somministrata sotto forma di compresse convenzionali tre volte al giorno. Quando la dose orale viene aumentata l’esposizione plasmatica complessiva al cortisolo aumenta in maniera meno che proporzionale. L’esposizione aumenta di tre volte quando la dose di idrocortisone a rilascio modificato aumenta da 5 mg a 20 mg.
La velocita di assorbimento dell’idrocortisone e ridotta dopo l’assunzione di cibo risultando in un ritardo nel tempo di comparsa della concentrazione plasmatica massima da una media di meno di 1 ora a piú di 2,5 ore. D’altro canto, l’entita dell’assorbimento e della biodisponibilita e stata superiore del 30% circa per la compressa da 20 mg dopo l’assunzione di cibo rispetto che a digiuno, e non e stato osservato alcun mancato assorbimento né dose dumping.
Distribuzione
Nel plasma, il cortisolo e legato alla globulina legante i corticosteroidi (CBG o transcortin a) e all’albumina. Il legame e del 90% circa.
Eliminazione
E stato riportato che l’emivita terminale e pari a 1,5 ore circa in seguito a do; aggjo endov moso e orale di compresse di idrocortisone. L’emivita terminale del cortisolo in segu,'o allA somministrazione di Plenadren e stata di 3 ore circa, con formula a rilascio controlla. .. Quest? mi ita terminale e simile alla farmacocinetica del cortisolo endogeno che e anche con secrezione controllata.
L’idrocortisone (cortisolo) e un farmaco lipofilico che viene eliminato completamente attraverso il metabolismo con una bassa clearance e di conseguenza con Nssi assi di estrazione intestinale ed epatica.
L’idrocortisone viene eliminato completamente per via metabolica dagli enzimi 11BHSD tipo 1 e tipo 2 e da CYP 3A4 nel fegato e nel tessuto periferico. Il CYP 3A4 partecipa alla clearance del cortisolo mediante la formazione di 6p-idrossicortisolo che viene escreto nell’urina. Si prevede che il trasporto del cortisolo attraverso le membrane \eng., mediae es^enzialmente dalla diffusione passiva e quindi le clearance renali e biliari sono trascuraLdi.
Popolazioni speciali
Insufficienza renale
Una piccola quant/a di .oAisolo vi^ne escreta nell’urina senza alcuna modifica (<0,5% della produzione giornaliem); ci . s>nifica che il cortisolo viene eliminato completamente per via metabolica. Poiché una grave insufficienza renale puo influire sui medicinali eliminati completamente attraverso il metabolismo, potrebbe essere necessario un aggiustamento della dose.
Insufficienza e pQiica
Non e stato effettuato alcuno studio nei pazienti con insufficienza epatica, ma i dati disponibili in letteratura per l’idrocortisone mostrano che non e necessario alcun aggiustamento della dose nell’insufficienza epatica da lieve a moderata. Nel caso di grave insufficienza epatica, la massa epatica funzionale diminuisce e quindi diminuisce la capacita di metabolizzazione dell’idrocortisone. Cio po trebbe rendere necessaria una personalizzazione della dose.
Popolazione pediatrica
Non sono disponibili dati farmacocinetici per bambini o adolescenti.
5.3 Dati preclinici di sicurezza
Gli esperimenti condotti sugli animali hanno dimostrato che l’esposizione prenatale a dosi molto alte di glucocorticoidi puo indurre malformazioni (palatoschisi, malformazioni scheletriche). Gli studi sugli animali hanno dimostrato altresi che l’esposizione prenatale a dosi di glucocorticoidi alte (ma inferiori a dosi teratogene) puo essere associata a un maggiore rischio di ritardo della crescita intrauterina, patologie cardiovascolari in etá adulta e modifiche permanenti nella densitá del recettore dei glucocorticoidi, nel turnover dei neurotrasmettitori, e nel comportamento.
6. INFORMAZIONI FARMACEUTICHE
6.1 Elenco degli eccipienti
Nucleo
Ipromellosa
Cellulosa microcristallina Amido pregelatinizzato (di mais)
Silice colloidale anidra Magnesio stearato
Rivestimento Macrogol (3350)
Alcol polivinilico Talco
Titanio diossido (E171)
6.2 Incompatibilita Non pertinente.
6.3 Periodo di validita
3 anni
6.4 Precauzioni particolari per la con .ervazune
Questo medicinale non richiede alcuna condizione particolare di conservazione.
6.5 Natura e contenuto del contenitore
Flaconi HDPE con tappo a vite PP contenenti 50 compresse a rilascio modificato.
Scatola di cartone x nten enA 1 flacone da 50 compresse a rilascio modificato e confezioni multiple contenenti 100, 150 e 300 compresse a rilascio modificato (2, 3 e 6 scatole da 50 compresse a rilascio modificato).
E possibile che non tutte le confezioni siano commercializzate.
6.6 Prt’a' z'oni particolari per lo smaltimento
Il medicinale non utilizzato e i rifiuti derivati da tale medicinale devono essere smaltiti in conformitá della normativa locale vigente.
7. TITOLARE DELL’AUTORIZZAZIONE ALL’IMMISSIONE IN COMMERCIO
ViroPharma SPRL Rue Montoyer 47 B - 1000 Bruxelles Belgio
8. NUMERO(I) DELL’AUTORIZZAZIONE ALL’IMMISSIONE IN COMMERCIO
EU/1/11/715/002
EU/1/11/715/006
EU/1/11/715/007
EU/1/11/715/008
9. DATA DELLA PRIMA AUTORIZZAZIONE/RINNOVO DELL’AUTORIZZAZIONE
Data della prima autorizzazione: 3 novembre 2011
10. DATA DI REVISIONE DEL TESTO
{MM/AAAA}
Informazioni piú dettagliate su questo medicinale sono disponibili sul sito web dell’Agenzia europea dei medicinali http://www.ema.europa.eu

Documento reso disponibile da AIFA il 28/02/2014 21
Riassunto delle caratteristiche del prodotto Plenadren

Foglio illustrativo: informazioni per l’utilizzatore
Plenadren 5 mg compresse a rilascio modificato Plenadren 20 mg compresse a rilascio modificato
Denominato Plenadren nel foglio illustrativo Idrocortisone
Legga attentamente questo foglio prima di prendere questo medicinale perché contiene importanti informazioni per lei.
- Conservi questo foglio. Potrebbe aver bisogno di leggerlo di nuovo.
- Se ha qualsiasi dubbio, si rivolga al medico o al farmacista.
- Questo medicinale e stato prescritto soltanto per lei. Non lo dia ad altre persone, anche e i sintomi della malattia sono uguali ai suoi, perché potrebbe essere pericoloso.
- Se si manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati i q^esi^ foglio, si rivolga al medico o al farmacista. Vedere paragrafo 4.
Contenuto di questo foglio:
1. Che cos’e Plenadren e a cosa serve
2. Cosa deve sapere prima di prendere Plenadren
3. Come prendere Plenadren
4. Possibili effetti indesiderati
5. Come conservare Plenadren
6. Contenuto della confezione e altre informazioni
1. Che cos’e Plenadren e a cosa serve
Plenadren contiene una sostanza chiamata idrocortisone (talvolta definita cortisolo). L’idrocortisone e un glucocorticoide che appartiene a un gnppo di medicinali chiamati corticosteroidi. I glucocorticoidi si trovano in natura nel nostro organnmo e antrNuiscono al nostro benessere e allo stato generale di salute.
Plenadren e utilizzato negli a^ulf per :l tr .^amento di una condizione nota come insufficienza surrenalica, o deficit di cortisolo. L’insufficienza surrenalica si verifica quando le ghiandole surrenali (poste al di sopra dei reni) non producono una quantitá sufficiente di ormone cortisolo. I pazienti affetti da insufficienza surrenalica di lungo periodo (cronica) hanno bisogno di una terapia sostitutiva per sopravvivere.
Plenadren sostituisce il cortisolo naturale che manca nell’insufficienza surrenalica. Il medicinale fornisce icoa-trnne all’organismo durante il giorno. Il livello di cortisolo nel sangue aumenta rapidamente fino a raggiungere un livello massimo, circa 1 ora dopo l’assunzione della compressa al mattino, per diminuire gradualmente nel corso della giornata e raggiungere un livello ematico ba^sis'lnio o pari a 0 in tarda serata e di notte quando i livelli devono essere bassi.
2. Cosa deve sapere prima di prendere Plenadren Non prenda Plenadren
- se e allergico all’idrocortisone o ad uno qualsiasi degli altri componenti di questo medicinale (elencati al paragrafo 6).
Avvertenze e precauzioni
Si rivolga al medico o al farmacista prima di prendere Plenadren
- se il suo stato le impedisce di assumere questo medicinale o la medicina non viene assorbita adeguatamente dallo stomaco. Questo puo verificarsi se ci sono problemi di stomaco che comprendono il vomito e/o la diarrea. In queste situazioni si raccomanda di consultare immediatamente un medico per sottoporsi a un trattamento di iniezioni di idrocortisone e somministrazione supplementare di fluidi.
- Nel caso di malattie di breve durata o transitorie come infezioni, febbre o situazioni che provocano un notevole stress fisico, come un intervento chirurgico: l’organismo non puo produrre la quantitá supplementare di cortisolo necessaria in queste situazioni e la dose dev’essere temporaneamente aumentata. Chiedere informazioni al medico sul modo piú opportuno per affrontare simili situazioni. Nel caso di un intervento chirurgico, informare il medico/il dentista prima dell’intervento in merito all’assunzione di questo medicinale.
- Se per qualsiasi motivo si osserva un peggioramento dello stato di salute generale nono'^nte l’assunzione del medicinale secondo la prescrizione medica, consulti immediatamente un medico.
- Se la ghiandola tiroidea non funziona normalmente informi il medico, poiché potrebbe essere necessario aggiustare la dose di Plenadren.
Bambini e adolescenti
L’uso di Plenadren non e stato studiato nei bambini né negli adolescenti di etá inferiore a 18 anni. Altri medicinali e Plenadren
Informi il medico o il farmacista se sta assumendo, ha recente^mz assunto o potrebbe assumere qualsiasi altro medicinale. Durante il trattamento di lunga durata con medicinali per il trattamento delle infezioni (antibiotici), il medico potrebbe ritenere opportuno effettuare un aggiustamento della dose di Plenadren. Se assunto con il mifepristone, un farma co u ato per interrompere la gravidanza, l’effetto di Plenadren potrebbe risultare ridotto.
Informi inoltre il medico o il farmacista se sta ťilizzando uno qualsiasi dei seguenti medicinali, perché potrebbe essere necessario modificare la dose di Plenadren:
• Fenitoina, carbamazepina e barbiturici - per il trattamento dell’epilessia
• Rifampicina o rifabutira - p r il t .tAm'nto della tubercolosi
• Ritonavir, efavirenz e nev ;rap;na - pe il trattamento delle infezioni HIV
• Iperico - per il trattamento della depressione e altre condizioni
• Ketoconazolo, itrac onazolo, pos aconazolo, voriconazolo - per il trattamento delle infezioni fungine
• Eritromicina, telitromicina, claritromicina - per il trattamento delle infezioni batteriche Plenadren con cibi e bevande
Non assuma questo medicinale con succo di pompelmo poiché il succo entra in conflitto con l’azione di questo medicinale.
Gi avi 'anz., a/attamento e fertilita
E importante continuare il trattamento con Plenadren durante la gravidanza. E improbabile che il trattamento con Plenadren in donne in stato di gravidanza con insufficienza surrenalica provochi effetti avversi sulla madre e/o sul bambino. Informi il medico in caso di gravidanza, poiché potrebbe essere necessario aggiustare la dose di Plenadren.
E possibile allattare al seno durante il trattamento con Plenadren. L’idrocortisone viene escreto nel latte materno. E improbabile che le dosi di idrocortisone utilizzate per la terapia sostitutiva abbiano effetti sul bambino. Informi comunque il medico se intende allattare al seno.
Se e in corso una gravidanza, se sospetta o sta pianificando una gravidanza, o se sta allattando con latte materno chieda consiglio al medico o al farmacista prima di prendere questo medicinale.
Guida di veicoli e utilizzo di macchinari
Plenadren potrebbe avere una lieve influenza sulla capacitá di guidare veicoli e utilizzare macchinari. Sono stati segnalati episodi di giramenti di testa di breve durata (vertigini) ed estrema stanchezza. L’insufficienza surrenalica non trattata o trattata inadeguatamente riduce la capacitá di concentrazione e influisce sulla capacitá di guidare veicoli e utilizzare macchinari. E quindi importante assumere questo medicinale secondo le istruzioni del medico quando si guidano veicoli o si utilizzano macchinari. Se e affetto da questa patologia, non guidi veicoli né usi macchinari prima di consultare un medico.
3. Come prendere Plenadren
Prenda questo medicinale seguendo sempre esattamente le istruzioni del medico o del farmacista. Se ha dubbi consulti il medico o il farmacista. La dose indicata e specifica per le sue esigenze e viene decisa dal medico.
• Al mattino appena svegli assumere le compresse di Plenadren intere con un bicchier d’acqua almeno 30 minuti prima di fare colazione, preferibilmente tra le 6.00 e le 8.00 del mattino.
• L’assunzione del farmaco deve avvenire preferibilmente in posizione eretta.
• La compressa va deglutita intera, senza dividerla, romperla o frana aan\ Q u este compresse rilasciano idrocortisone nell’organismo nell’intero arco della giornatV Se la compressa viene divisa, rotta o frantumata, la dose di idrocortisone contenuta nella compressa potrebbe non coprire tutta la giornata.
Necessita di dosi supplementari di Plenadren
Nel caso di malattie di breve durata o transitorie come Afeziom, febbre o situazioni che provocano un notevole stress fisico, come un intervento chirurgico, il suo organismo non puo produrre la quantitá supplementare di cortisolo necessario in queste situazioni e quindi sará necessario assumere piú idrocortisone. La dose dev’essere quindi temporaneamente aumentata e il medico le dirá se assumere altre compresse di idrocortisone piuttosto che di P'eriadren, o in aggiunta a Plenadren stesso. Consulti il medico e segua le istruzioni del cas'
Potrebbe essere necessario raddoppiare o triplicare la dose giornaliera di Plenadren in condizioni piú lievi come nel caso di una leggen inAzAne o lieve stress. In tal caso e necessario assumere la seconda dose di Plenadren da. 6 a 10 ore dopo la dose del mattino. Qualora non sia sufficiente raddoppiare la dose giornaliera, e necessario assumere una terza dose da 6 a 10 ore dopo la seconda dose (con 6-10 ore di intervallo tra le dosi). Alla fine della malattia, ritornare alla normale dose di mantenimento di Plenadren.
Se prende piu ’lenadr' n di quanto deve
Una dose eccesiva di Plenadren per piú di qualche giorno puo essere pericolosa per la salute. Si potrebbe verificare un aumento della pressione del sangue, un aumento ponderale e un livello ec'essi o di Aucosio nel sangue. Occasionalmente e necessario aumentare la dose di Plenadren perché l’organismo possa affrontare situazioni di maggiore stress, dovute per esempio alla febbre. Se si richiedono dosi supplementari di Plenadren frequentemente e regolarmente, e necessario contattare il medico per ridefinire la dose di mantenimento.
Se dimentica di prendere Plenadren
Se ha dimenticato di assumere la compressa al mattino, la prenda quanto prima. Non prenda una dose doppia per compensare la dimenticanza della dose.
Se interrompe il trattamento con Plenadren
L’interruzione del trattamento con Plenadren potrebbe avere esiti fatali. E importante percio continuare ad assumere Plenadren secondo la prescrizione del medico. Non interrompa il trattamento con Plenadren senza consultare il medico.
Se ha qualsiasi dubbio sull’uso di questo medicinale, si rivolga al medico o al farmacista.
4. Possibili effetti indesiderati
Come tutti i medicinali, questo medicinale puo causare effetti indesiderati sebbene non tutte le persone li manifestino.
Se cambia il trattamento, passando da altre compresse di idrocortisone a Plenadren potrebbe subire effetti indesiderati nel corso delle prime settimane. Questi possono essere: dolori allo stomaco, nausea e stanchezza. Normalmente questi effetti scompaiono col passare del tempo, in caso contrario consulti il medico.
Elenco degli effetti indesiderati di Plenadren:
Molto comune (puo interessare piú di 1 persona su 10)
• Stanchezza
Comune (puo interessare fino a 1 persona su 10)
• Diarrea e vomito, mal di gola/raffreddore, sindrome influenzale provocata da un’infezione virale
• Calo del colesterolo (colesterolo buono) nel sangue (sulla base dei dati dell’emocromo), aumento ponderale
• Carie
• Sonnolenza, giramenti di testa
• Secchezza dell’occhio; sensazione di sabbia negli occhi; irma^- ne oculare
• Dolori allo stomaco/aciditá gastrica, nausea
• Eruzione pruriginosa
• Gonfiore delle articolazioni.
Altri effetti indesiderati sono stati riportati per altri medicinali con idrocortisone. Questi medicinali sono stati somministrati anche per induaziom div erse dalla terapia sostitutiva dell’insufficienza surrenalica, spesso con dosi piú alte. La frequenza di tali effetti indesiderati non e nota (non puo essere definita sulla base dei dati disponibili). Se nota la comparsa di uno qualsiasi di questi effetti indesiderati, consulti il medico.
Non nota (la frequenza nor puo essere definita sulla base dei dati disponibili):
• Maggiore predisposizi one alle infezioni
• Diabete o problemi con i livelli di glucosio nel sangue (sulla base dei dati dell’emocromo)
• Ritenzione idrica e di sali che provoca gonfiori e aumento della pressione del sangue (evidenziati nel corso dell’esame medico) e basso livello di potassio nel sangue
• Cambiamenti di umore, per esempio sovreccitazione o perdita di contatto con la realtá
• D;stu"bi \el sonno
• Aumento della pressione oculare (glaucoma), opacizzazione del cristallino (cataratta)
• Aciditá gastrica, aggravamento di eventuali ulcere gastriche
• Indebolimento delle ossa, che puo provocare fratture ossee
• Smagliature, lividi, eruzione simile all’acne, crescita eccessiva di peluria sul volto, cicatrizzazione rallentata.
Segnalazione degli effetti indesiderati
Se manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga al medico o al farmacista. Lei puo inoltre segnalare gli effetti indesiderati direttamente tramite il sistema nazionale di segnalazione riportato nell’Allegato V*.
Segnalando gli effetti indesiderati lei puo contribuire a fornire maggiori informazioni sulla sicurezza di questo medicinale.
5. Come conservare Plenadren
Tenere questo medicinale fuori dalla vista e dalla portata dei bambini.
Non usi questo medicinale dopo la data di scadenza che e riportata sull’etichetta e sulla scatola dopo Scad. La data di scadenza si riferisce all’ultimo giorno di quel mese.
Questo medicinale non richiede alcuna condizione particolare di conservazione.
Non getti alcun medicinale nell’acqua di scarico e nei rifiuti domestici. Chieda al farmacista c me eliminare i medicinali che non utilizza piú. Questo aiuterá a proteggere l’ambiente.
6. Contenuto della confezione e altre informazioni Cosa contiene Plenadren
- Il principio attivo e l’idrocortisone.
Plenadren 5 mg: Ogni compressa a rilascio modificato contiene 5 mg di drocorďsone.
Plenadren 20 mg: Ogni compressa a rilascio modificato contiene 20 mg di idrocortisone.
- Gli altri componenti sono ipromellosa (E464), cellulosa microcristallina (E460), amido pregelatinizzato, silice colloidale anidra (E551) e magnesio stearato. Il sistema di rivestimento e una miscela di macrogol (3350), alcole poli' mENo, talc. vE553b) e ossido di titanio (E171). Le compresse da 5 mg contengono anche ossido di ferro rosso (E172), ossido di ferro giallo (E172) e ossido di ferro nero (E172).
Descrizione dell’aspetto di Plenadren e coiten'to della confezione
Le compresse a rilascio modificato sono rotonde (diametro 8 mm) e convesse.
Le compresse da 5 mg sono rosa. Le compresse da 20 mg sono bianche.
Plenadren e fornito in flaconi con tappo a vite contenenti 50 compresse.
Scatole contenenti un flacone da 50 compresse a rilascio modificato.
Le confezioni multiple pos ono contenere 2 scatole da 50 compresse (in totale 100 compresse a rilascio modificato), 3 s^ato’e < a 50 compresse (in totale 150 compresse a rilascio modificato) o 6 scatole da 50 compresse (in totale 300 compresse a rilascio modificato).
E possibile chi non tuEe le confezioni siano commercializzate.
Titolare dell’autorizzazione all’immissione in commercio e produttore
ViroTharma SPrL Rue Montoyer 47 B- 1000 Bruxelles Belgio
Questo foglio illustrativo e stato aggiornato il
Altre fonti d’informazioni
Informazioni piú dettagliate su questo medicinale sono disponibili sul sito web dell’Agenzia europea dei medicinali: http://www.ema.europa.eu. Inoltre, sono riportati link ad altri siti web su malattie rare e relativi trattamenti terapeutici.

Documento reso disponibile da AIFA il 28/02/2014 46